ابر برجسب
هلیوم گاز نیتروژن گاز کربن دی اکسید انواع بلوک شیشه ای گاز استیلن گاز مونوکسید کربن توری مرغی گاز هیدروژن گاز نئون گاز آرگون بتن ایزوگام بتن چیست تفاوت چوب پلاست و ترمووود گاز هلیومجدیدترین یادداشتها
همهبایگانی
- اسفند 1400 1
- بهمن 1400 1
- دی 1400 3
- آذر 1400 1
- آبان 1400 1
- مهر 1400 2
- مرداد 1400 1
- خرداد 1400 1
- اردیبهشت 1400 1
- اسفند 1399 1
- بهمن 1399 2
- دی 1399 2
- آذر 1399 3
- آبان 1399 3
- مهر 1399 7
- شهریور 1399 5
- مرداد 1399 4
- تیر 1399 6
- خرداد 1399 4
- اردیبهشت 1399 1
- فروردین 1399 1
- اسفند 1398 4
- بهمن 1398 4
- دی 1398 4
- آذر 1398 8
- آبان 1398 5
- مهر 1398 12
- شهریور 1398 12
- مرداد 1398 14
- تیر 1398 6
- خرداد 1398 18
- اردیبهشت 1398 32
- فروردین 1398 23
- اسفند 1397 16
- بهمن 1397 16
- دی 1397 20
- آذر 1397 2
جستجو
هلیوم چندمین عنصر در جدول تناوبی است ؟
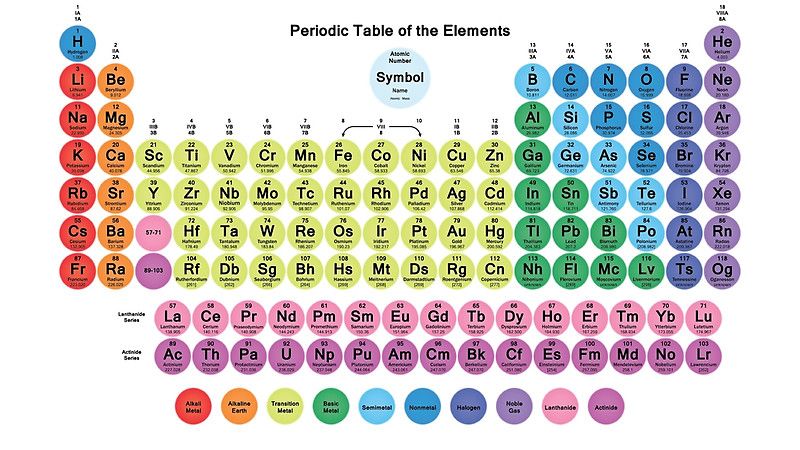
عنصر هلیوم در جدول تناوبی به عنوان دومین عنصر با نماد شیمیایی He و عدداتمی 2 شناخته شده است. هلیوم در جدول تناوبی اولین عنصر از گروه گاز های نجیب است. عناصر این گروه عناصر بی اثر هستند که به ندرت با ماده ی دیگری وارد واکنش شیمیایی می شوند.
فاز پلاسما و گاز
هلیوم به صورت طبیعی در حالت گازی دیده می شود. هلیوم پس از هیدروژن بالاترین ظرفیت هدایت حرارتی و سرعت صوت را دارد. با توجه به اندازه ی کوچکی که اتم های هلیوم دارند، نفوذ آن از درون جامدات سه برابر بیشتر از هواست و 65% بیشتر از هیدروژن است. این گاز به صورت محدودی در آب انحلال پذیر است.
فاز جامد و مایع هلیوم
هلیوم با کاهش دما می تواند مایع شود و از هلیوم مایع به عنوان خنک کننده ی قوی استفاده می کنند. می توان گفت هلیوم تنها عنصری است که در فشار معمولی با کاهش دما امکان انجماد ندارد. برای جامد شدن هلیوم همزمان با کاهش دما فشار نیز باید افزایش پیدا کند. حجم هلیوم جامد با افزایش فشار تا 30% کاهش پیدا می کند. هلیوم جامد را توانسته اند در 0 درجه کلوین و فشار 25 بار به دست آورند.
ایزوتوپ های هلیوم
از عنصر هلیوم تا کنون 8 ایزوتوپ مختلف شناسایی شده است. اما، تنها دو ایزوتوپ هلیوم پایدار هستند و مابقی در کمتر از یک ثانیه تجزیه می شوند. هلیوم 3 و هلیوم 4 دو ایزوتوپ پایدار هلیوم هستند و فراوانی هلیوم 4 بسیار بیشتر از ایزوتوپ هلیوم 3 است.
فراوانی و تولید هلیوم
با وجود این که عنصر هلیوم دومین عنصر فراوان در کل جهان هستی است، در کره زمین منابع فراوانی ندارد. تنها 4 هزارم درصد از جو زمین از هلیوم تشکیل شده استا و استحصال هلیوم از جو عملاً امکان پذیر نیست و در واقع هلیوم را از میدان های گاز طبیعی به دست می آورند.
در میدان های گاز طبیعی کشف شده، تا 7% هلیوم وجود دارد که با استخراج گاز طبیعی، هلیوم را نیز استخراج و جدا سازی می کنند. ویژگی های منحصر به فرد هلیوم باعث شده است تقاضا برای مصرف آن در دنیا زیاد باشد. اما هلیوم نیز مانند منابع نفتی در زمین محدود و تجدید ناپذیر است و بشر باید در مصرف آن صرفه جویی کند.
واکنش گاز های بی اثر
یکی از مهمترین ویژگی های هلیوم که سبب توسعه ی کاربرد های آن شده است بی اثر بودن و واکنش ناپذیر بودن آن است که البته این ویژگی را دیگر گاز های نجیب نیز دارند.
ترکیباتی از گاز های نجیب با اتمی بالا دیده شده است. اما، هلیوم پس از نئون بی اثر ترین گاز نجیب است. چون هلیوم در جدول تناوبی اولین عنصر از گروه گاز های نجیب است و کمترین عدد اتمی را دارد، با هیچ عنصر دیگری وارد واکنش نمی شود.